Опухоли надпочечников относятся к одному из важных и трудных в диагностическом и лечебном плане разделов клинической онкологии.
Эти заболевания объединяют группу различных вариантов опухолей, в число которых входят и гормональноактивные опухоли надпочечников. Общепринято классифицировать опухоли надпочечников на доброкачественные и злокачественные. Надпочечники имеют сложное гистологическое строение и состоят из двух отличающихся друг от друга в эмбриологическом и морфологическом отношении слоев – коркового и мозгового.
В настоящее время в основном используется классификация, основанная на гистогенетическом принципе:
I. Эпителиальные опухоли коры надпочечников:
– аденома,
– карцинома.
II. Мезенхимальные опухоли:
– миелолипома,
– липома,
– фиброма,
– ангиома.
III. Опухоли мозгового слоя надпочечников:
– феохромоцитома,
– нейробластома,
– ганглиома,
– симпатогониома.
Кора надпочечников развивается из мезодермальной ткани, и корковый слой состоит из трех зон (клубочковой, пучковой и сетчатой) и образован железистой и соединительной тканями. Клубочковая зона – самый поверхностный слой, который вырабатывает минералокортикоиды, регулирующие внутри– и внеклеточную концентрацию натрия и калия. Пучковая зона (самая широкая) продуцирует 70% гормонов коры. Основными их представителями являются кортизон, гидрокортизон и кортикостерон, которые регулируют углеводный, белковый и жировой обмен. В сетчатой зоне синтезируются половые стероидные гормоны – андрогены: андростендион, дeгидроэпиандростерон, а также эстрогены: эстрадиол, эстрон, эстриол.
Мозговой слой содержит хромаффинные клетки, которые окрашиваются хромовыми солями, и симпатические нервные клетки. Мозговое вещество синтезирует катехоламины (адреналин, норадреналин). Следует иметь в виду развитие катехоламинсекретирующих опухолей из нехромаффинных клеток симпато–адреналовой системы. Возможность такого их происхождения объясняется общностью эмбриогенеза феохромоцитов и других клеток нервной ткани. Крайне редко в надпочечниках могут встречаться гемангиомы, ангиосаркомы, лимфангиомы, лейомиомы, лейомиосаркомы, лимфомы, опухоли стромы гонадального тяжа, первичные меланомы.
Среди объемных образований надпочечников, протекающих без эндокринных нарушений, встречаются миелолипомы. Это доброкачественные образования, состоящие из зрелой жировой соединительной ткани и гемопоэтических элементов. Они нередко сочетаются с гормоноактивными и «немыми» опухолями надпочечников. Достигая больших размеров, эти новообразования могут вызывать атрофические изменения в надпочечнике и приводить к развитию гипокортицизма. Нередко они локализуются и вне надпочечника: в периренальной и периадреналовой клетчатке, не всегда инкапсулированы.
Клиническая картина гормоноактивных опухолей коры надпочечников обусловлена гиперпродукцией тех или иных стероидных гормонов, в зависимости от структуры опухоли. Нередко наблюдается картина смешанного гиперкортицизма, когда новообразование продуцирует несколько гормонов, различных по своему биологическому действию на организм. Среди гормоноактивных опухолей коры надпочечников выделяют следующие.
Альдостерома – опухоль, продуцирующая альдостерон, вызывает первичный альдостеронизм. Первичный альдостеронизм (синдром Конна) характеризуется определенным симптомокомплексом: гипертензией, мышечной слабостью и алкалозом с гипокалиемией. Клинически синдром Конна отличается гипертензией (систолической и диастолической), умеренной полиурией и более или менее выраженным ослаблением отдельных мышечных групп. Почти у всех больных могут быть положительными симптомы Труссо и Хвостека. Слабость отдельных мышечных групп может переходить в скоропроходящие парезы, вызванные гипокалиемией. Эти симптомы сопровождаются усиленным аппетитом, чувством сухости во рту, головными болями.
При лабораторных исследованиях может отмечаться повышенное выделение с мочой альдостерона. Для диагностики гиперальдостеронизма применяется спиронолактоновый тест. При пробе с дихлотиазидом уровень калия в крови при отсутствии альдостеронизма и у больных со вторичным альдостеронизмом существенно не меняется; у больных же с первичным альдостеронизмом – резко снижается.
Низкий уровень калия сопровождается электрокардиографическими изменениями. Алкалоз является характерным признаком синдрома.
Кортикостерома (глюкостерома) – выделяет глюкокортикоиды и клинически проявляется синдромом Иценко–Кушинга. Различают три разновидности эндогенного синдрома Иценко–Кушинга:
1) гипофизарный синдром Кушинга (болезнь Кушинга), обусловлен нерегулируемой избыточной секрецией АКТГ в аденогипофизе. Избыток АКТГ стимулирует продукцию глюкокортикоидов в коре надпочечников, что приводит к гиперкортизолемии;
2) надпочечниковый синдром Иценко–Кушинга, обусловлен нерегулируемой избыточной секрецией кортизола опухолями коры надпочечника или гиперпластической тканью коры надпочечников (узловая, реже – мелкоузелковая гиперплазия). При надпочечниковом синдроме Иценко–Кушинга уровень АКТГ в плазме понижен;
3) эктопический синдром Иценко–Кушинга, обусловлен нерегулируемой избыточной секрецией АКТГ негипофизарными злокачественными новообразованиями и характеризуется сильным повышением АКТГ в плазме крови.
Синдром Иценко–Кушинга имеет целый ряд характерных симптомов, таких как ожирение с распространением излишка жира (прежде всего на теле), круглая форма лица («лунообразное лицо»), истончение кожи и атрофия эластических волокон, в результате чего на животе, бедрах и ягодицах возникают красноватые дермоэктазии, мышцы ослабевают, появляется остеопороз, склеротические изменения в сосудах, сопровождающиеся гипертензией, стероидный диабет, протекающий с чрезмерным аппетитом и полиурией, наконец, алкалоз с низким уровнем калия и хлора в крови. Вместе с чрезмерной секрецией кортизола увеличивается образование 17–кетостероидов с андрогенным влиянием. В результате появляются такие симптомы, как чрезмерное оволосение, глухой голос, задержка менструаций, гипертрофия клитора. Гипертензия, низкий уровень калия, увеличенный уровень натрия являются результатами усиленной продукции альдостерона.
У всех больных, у которых имеет место ожирение вместе с гипертензией, расстройствами углеводного обмена, кожные дермоэктазии и остеопороз, следует предполагать наличие синдрома Иценко–Кушинга.
Андростерома – опухоль, секретирующая преимущественно андрогены. Андростерома – гормональноактивная, вирилизирующая опухоль, продуцирующая мужские половые гормоны. Андростеромы относятся к редкой патологии (1–3% всех опухолей). Почти в 60% случаев андростерома бывает злокачественной, метастазирует в печень, легкие, забрюшинные лимфатические узлы. Андростерома чаще развивается у женщин, в основном в возрасте до 35–40 лет. Клинические проявления опухоли обусловлены вирилизирующими и анаболическими свойствами андрогенов. Степень вирилизации зависит от гормональной активности опухоли, длительности заболевания. У девочек раннего возраста заболевание характеризуется явлениями интерсексуализма и преждевременным физическим развитием: наблюдается гипертрихоз, увеличение клитора, низкий, грубый голос, угри на лице и туловище.
Под влиянием анаболического эффекта андрогенов усиливается развитие мышц, ускоряются процессы роста одновременно с ранним закрытием эпифизарных зон роста. Характерны низкорослость с непропорциональным укорочением конечностей и хорошо развитыми мышцами, развитие вторичных половых признаков по гетеросексуальному типу. Преждевременное половое развитие нельзя считать истинным, поскольку оно, как правило, выражается появлением вторичных половых признаков, в то же время половые железы соответствуют возрасту ребенка. По мере увеличения сроков заболевания становится более выраженным мужское телосложение, женские черты сглаживаются, уменьшается подкожно–жировой слой, выделяется мускулатура и увеличивается ее масса. Грудные железы подвергаются более или менее выраженной атрофии.
Менструации либо вообще не появляются, либо нарушаются по типу олигоменореи, и вскоре наступает аменорея. У женщин начинают расти борода и усы, голова начинает лысеть. Самочувствие больных на ранних стадиях остается удовлетворительным. Под воздействием андрогенов могут даже возрасти физическая активность и работоспособность.
У мальчиков развитие андростеромы сопровождается преждевременным половым развитием. Половой член значительно увеличивается, но семенники остаются недоразвитыми. Хорошо выражены вторичные половые признаки, рано появляется половое влечение.
У больных андростеромой не выявляется значительных обменных нарушений. Количество андрогенов, определяемых в крови и моче, возрастает в десятки раз.
Кортикоэстерома – опухоль, выделяющая эстрогены. Встречается крайне редко. Эстрогено–генитальный синдром наблюдается главным образом у молодых мужчин. Больные жалуются на общую слабость, увеличение грудных желез, ожирение, выпадение волос на лице, половую слабость. Не всегда перечисленные симптомы встречаются одновременно. Наиболее частым признаком кортикоэстеромы является гинекомастия.
Cмешанные опухоли. «Чистые» опухоли типа альдостером, кортикостером, андростером, кортикоэстером и им подобным встречаются редко. Чаще обнаруживаются смешанные опухоли с преобладанием признаков того или иного синдрома в зависимости от повышенного образования тех или иных стероидов. Эти опухоли чаще всего имеют смешанное гистологическое строение.
Гормональнонеактивные опухоли коры надпочечников протекают обычно без клинических и биохимических признаков нарушения функции соответствующих слоев коры надпочечника; обнаруживаются в любом возрасте у лиц обоего пола в 0,5–10% случаев, нередко выявляются при обследовании по поводу другого заболевания. Для обозначения подобных опухолей наиболее часто используется термин «инциденталома» (от англ. incidental – случайный).
Опухоли, относящиеся к гормональнонеактивным опухолям надпочечников, являются, как правило, объектом исследования, наблюдения и лечения онкологов. До периода использования таких высокочувствительных инструментальных методов исследования, как УЗИ, КТ, МРТ, и других современных методов обследования больных опухоли надпочечников, особенно их злокачественные варианты, диагностировали в основном только при развитии у пациентов клинических проявлений болезни.
В настоящее время благодаря внедрению в повседневную клиническую практику вышеперечисленных неинвазивных, но весьма информативных методов обследования больных, резко возросло число больных с новообразованиями в забрюшинном пространстве.
Протекают эти новообразования обычно без клинических и биохимических признаков нарушения функций надпочечников; обнаруживаются в любом возрасте у лиц обоего пола в 0,5–10% случаев; выявляются они и при аутопсиях у лиц, умерших от неэндокринных заболеваний с частотой 1,5–8,7% . Среди гормональнонеактивных опухолей коры надпочечника основную массу составляют аденомы. Основная масса этих опухолей представляет собой четко сформированные и хорошо инкапсулированные узлы солидного строения: в зависимости от типа формирующих их клеток на разрезе они от светло–желтого до темнокоричневого цвета. Их диаметр – от менее 1,0 до 4,0–5,0 см. Значительно реже аденом (примерно в 4 раза) встречаются карциномы, составляя, по данным различных авторов, не более десятых или даже сотых долей процента от числа всех опухолей надпочечников. Выявляются они, как правило, поздно, когда достигают больших размеров – 10–30 и более см, хотя могут быть и меньшего диаметра – 6–10 см.
Опухоли мозгового слоя надпочечников – феохромоцитомы относятся к эндокринноклеточным опухолям АПУД–системы. Чаще развиваются у лиц в возрасте 20–50 лет. Зрелые эндокринные (хромаффинные) клетки надпочечника секретируют катехоламины: дофамин, норадреналин, адреналин. Развивающиеся опухоли мозгового слоя могут быть гормональноактивными и гормональнонеактивными. Клиническая диагностика последних может быть длительно затруднена, так как они не проявляются гормональными нарушениями и выявляются случайно или при достижении определенных размеров. Феохромоцитомы крайне разнообразны по своему клиническому течению и прогнозу, они также представляют часто значительные трудности и при морфологическом исследовании, особенно в плане дифференциальной диагностики и, главным образом, определения степени их злокачественности. Размер опухоли, клеточный и ядерный полиморфизм феохромоцитом, даже резко выраженная дискомплексация клеточных структур, прорастание в капсулу и инвазия в сосуды не всегда соответствует клинически злокачественному течению. Наиболее надежным признаком малигнизации феохромоцитом следует считать наличие метастазов.
По клиническому течению различают несколько форм феохромоцитом: бессимптомную, симпато–адреналовую с пароксизмальной гипертонией и с постоянной гипертонией [30].
Наиболее известна классическая – пароксизмальная форма, при которой появляются гипертонические кризы. В межкризовые периоды артериальное давление остается нормальным. Внезапное повышение артериального давления может сопровождаться побледнением или покраснением кожных покровов, чувством страха, сердцебиением, парестезиями. Зрачки после кратковременного расширения резко суживаются, нарушается зрение. Отмечается набухание вен шеи, судороги, резкая потливость, озноб, повышение температуры тела. Нередко появляются одышка, боли в животе, поясничной области, за грудиной. Длительность приступов может длиться от нескольких минут до нескольких часов с исходом в улучшении самочувствия, иногда с элементами эйфории, потливостью, полиурией.
Важными диагностическими признаками катехоламинового криза являются лейкоцитоз, гипергликемия и глюкозурия. В межкризовый период у части больных выявляется нарушение толерантности к углеводам [8].
Постоянная форма артериальной гипертензии характеризуется стойким повышением артериального давления без кризов и напоминает течение гипертонической болезни, от которой ее бывает трудно отличить. Нередко только отсутствие эффективности традиционной гипотензивной терапии наводит на мысль о возможности надпочечникового происхождения стойкой гипертензии.
Cмешанная форма отличается тем, что гипертонические кризы возникают на фоне постоянно повышенного артериального давления, они протекают менее типично, чем у больных с пароксизмальной формой, чаще доминируют симптомы хронического поражения сердечно–сосудистой системы [9].
Злокачественные опухоли надпочечников характеризуются не только степенью своей гормональной активности, но и особенностями метастазирования. Для них характерны как лимфогенный путь метастазирования, так и гематогенный.
Злокачественные опухоли коркового слоя надпочечников обладают выраженной тенденцией к преимущественному гематогенному метастазированию, что объясняется особой подвижностью клеток мезенхимального генеза вообще, обилием тонкостенных сосудов в строме опухоли, а также иммунодепрессантным эффектом глюкокортикоидов, освобождающихся при некрозах и кровоизлияниях в опухоли. Вообще гематогенные метастазы отмечаются в легких, костной системе, головном мозге, желудочно–кишечном тракте, почках, печени, матке, железах внутренней секреции.
Злокачественные опухоли хромаффинной ткани надпочечников также характеризуются быстрым распространением метастазов в легкие, кости, головной мозг, лимфатические узлы.
Метастазы в надпочечники
Надпочечники занимают четвертое место после легких, печени и костей по частоте встречаемости метастазов. Последние обнаруживаются в них в 9–27% случаев злокачественных новообразований других органов; нередко метастазы двусторонние (41% случаев). Чаще всего в надпочечники метастазируют рак легких и молочных желез, реже – рак почек, желудочно–кишечного тракта, поджелудочной железы, семинома, меланома. Метастазы могут быть солитарными и множественными. При разрушении метастазами более 90% адреналовой ткани у больных развивается надпочечниковая недостаточность. В отличие от первичных опухолей надпочечников метастазы относятся к неинкапсулированным образованиям. Большие метастазы могут сопровождаться некротическими изменениями.
Диагностика
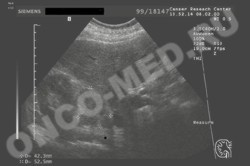
УЗИ - опухоль правого надпочечника
Диагностика гормональноактивных опухолей надпочечников при наличии соответствующих клинических симптомах заключается в топической диагностике, степени ее распространенности, подтверждении диагноза исследованием гормонального статуса и проведением соответствующих проб.
Значительно сложнее диагностика гормональнонеактивных опухолей, когда отсутствуют специфические клинические проявления поражения надпочечников, а гормональный статус не изменен.
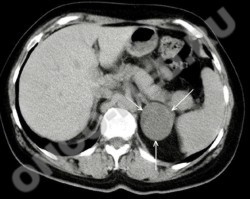
КТ - опухоль (аденома) надпочечника
Основной задачей начального этапа обследования больного, основанного на жалобах, данных физикального и гормонального исследований, является не столько постановка правильного диагноза, сколько заподозрить у больного наличие опухоли надпочечника.
Отсутствие при пальпации опухоли в правом или левом подреберьях не исключает необходимости дальнейшего осмотра всех органов. Обнаружив опухоль, необходимо определить ее подвижность, размеры, консистенцию.
Следующим этапом в обследовании больного с подозрением на опухоль надпочечника является установление наличия и локализации опухоли. Основными задачами, стоящими перед специальными методами топической диагностики, являются, с одной стороны, установление диагноза в максимально сжатые сроки, а с другой – оценка распространенности опухолевого процесса для определения возможности и объема предполагаемого оперативного вмешательства.
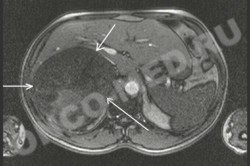
МРТ (горизонтальная проекция) -
опухоль правого надпочечника
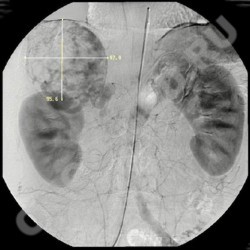
Важное место среди инструментальных методов исследования опухолей надпочечников в настоящее время заняло ультразвуковое исследование (УЗИ). Это, в первую очередь, обусловлено простотой его выполнения, высокой достоверностью полученных результатов, а также быстрота и доступность его выполнения. По мнению большинства авторов ультразвуковое исследование позволяет выявить опухоли надпочечников при минимальном диаметре от 1,0 до 2,0 см [20,31].
Значительно улучшает диагностику опухолей надпочечников использование рентгеновской компьютерной томографии (КТ). Минимальная величина опухоли, определяемая этим методом составляет от 0,5 до 1,0 см [5]. Он позволяет определить топографию надпочечников, форму, величину, структуру.
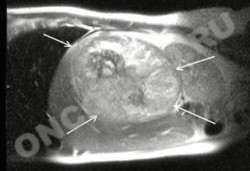
МРТ (сагиттальная проекция) -
опухоль правого надпочечника
С начала 80–х годов XX века в клинической практике появился принципиально новый метод диагностики – магнитно–резонансная томография (МРТ). К основным достоинствам МРТ относятся неинвазивность, безвредность, трехмерный характер получения изображений. Однако этот метод является одним из самых дорогостоящих и на применение МРТ при опухолях надпочечников существуют разноречивые мнения.
Особое место в комплексном обследовании больных с подозрением на опухоль надпочечников занимает ангиография. Для ангиографической диагностики опухолей надпочечников использовалась абдоминальная аортография, которая при необходимости дополнялась различными видами селективной артериографии. Все исследования проводили путем чрескожной пункционной катетеризации аорты через бедренную артерию по Сельдингеру с предварительной анестезией кожи 1% раствором новокаина.
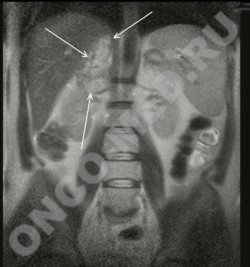
МРТ (фронтальная проекция) -
опухоль правого надпочечника
Внедрение за последние годы в диагностическую практику мультиспиральной компьютерной томографии позволили расширить и улучшить диагностику онкологических заболеваний. Пространственное отображение объемных образований, их взаиморасположение с окружающими анатомическими структурами могут быть полезными при выборе хирургического доступа и планирования объема хирургического вмешательства.
Успешно используемая в настоящее время для диагностики сосудистой патологии спиральная КТ-ангиография с получением ангиограмм высокого разрешения не только может конкурировать с прямой ангиографией, но и замещать проведение этого сложного инвазивного исследования.
Однако, несмотря на использование различных инструментальных методов, точный диагноз, особенно при гормональнонеактивных опухолях, позволяет установить лишь морфологическое исследование, которое возможно при исследовании материала, полученного при аспирационной тонкоигольной биопсии под контролем УЗИ или КТ. Точность метода равняется 80–90%.
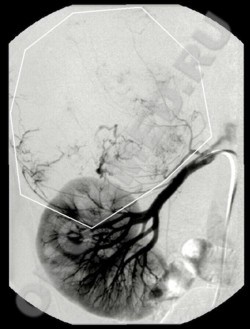
Селективная артериография
(артериальная фаза) - опухоль
(феохромоцитома) правого
надпочечника, кровоснабжение
которой происходит из бассейна
нижней надпочечниковой артерии
Ангиография (паренхиматозная
фаза) – умеренно васкуляризиро-
ванная опухоль (феохромоцитома)
правого надпочечника.
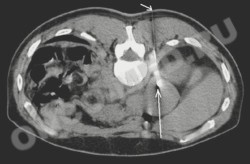
Тонкоигольная пункция опухоли
(адренокортикальный рак)
надпочечника под контролем КТ.
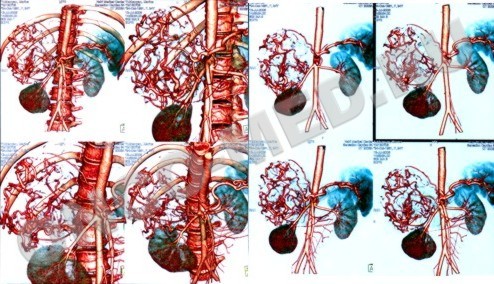
(опухоль правого надпочечника)
Лечение опухолей надпочечников
Основным методом лечения опухолей надпочечников в настоящее время считается хирургический.
Наличие опухоли надпочечников уже служит показанием к хирургическому лечению. Сопутствующие заболевания, большие размеры опухоли не являются абсолютным противопоказанием к хирургическому лечению.
Противопоказанием к операции могут быть: тяжелые сопутствующие заболевания, при которых противопоказано любое хирургическое вмешательство; опухоли с множественными отдаленными метастазами.
Хирургические вмешательства при опухолях надпочечников относятся к категории сложных. Это обусловлено глубиной расположения этого органа, сложными анатомическими взаимоотношениями с окружающими органами, опасностью повреждения крупных сосудов и близлежащих органов. Поэтому выбор оптимального операционного доступа к надпочечникам должен удовлетворять следующим требованиям: быть малотравматичным, создавать наибольший простор в ране, обеспечивая хорошую видимость, давать возможность для широкой ревизии органов брюшной полости и путей метастазирования. Выбор хирургического доступа зависит от размеров опухоли, ее гормональной активности, локализации.
Хирургические доступы к надпочечникам
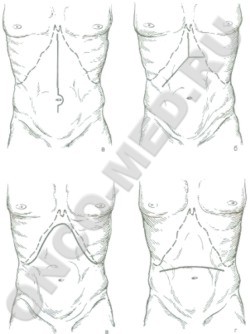
а - по E.H.Elison (1960)
б - по J.Aird, P.Helman (1955)
в - по L.River и соавт. (1953)
г - по M.Galante и соавт. (1954)
До сих пор не существует оптимального доступа к надпочечникам, который бы в полной мере отвечал всем онкологическим принципам в хирургии. В последнее время все чаще при больших опухолях надпочечников (свыше 6 см) применяют торакофренотомию в 10–м межреберье. Он практически удовлетворяет требованиям, описанным выше, но для него характерны осложнения, связанные с пневмотораксом и инфицированием плевры. Разнообразие предложенных абдоминальных хирургических доступов мало влияет на оперативные приемы при мобилизации и удалении надпочечников. Они сводятся к мобилизации двенадцатиперстной кишки при правосторонней адреналэктомии и мобилизации селезеночного угла ободочной кишки – при левосторонней.
Из анализа клинического материала о достоинствах и недостатках поясничных, трансабдоминальных и трансторакальных подходов к надпочечникам следует, что большинство поясничных доступов связано с рассечением большого мышечного массива и резекцией нижних ребер и не обеспечивает адекватной лимфодиссекции. Все чрезбрюшинные доступы (независимо от направления разреза) также травматичны и не обеспечивают должного удобства при визуализации надпочечника. Среди осложнений, развивающихся во время операции, преобладают кровотечения из центральной вены надпочечника, диафрагмальных и селезеночных сосудов, а так же повреждение селезенки и поджелудочной железы. К ранним послеоперационным осложнениям, связанным с видом доступа, относятся гнойно–инфекционные – нагноение операционной раны, паранефрит, перитонит, плеврит.
Смитуайка, Юнга, Лериша
Совершенствование хирургического метода, единственно радикального при данной патологии, остается одной из актуальных проблем современной онкологии. Во многом это связано с местным распространением опухоли и трудными условиями оперирования.
Торакофренотомия в X м/р
В нашей клинике разработан и внедрен новый хирургический доступ (трансабдоминальная адреналэктомия с мобилизацией правой доли печени) при удалении опухолей надпочечников, позволяющий удалять большие новообразования с минимальной операционной травмой для организма.

Абдоминоторакофренотомия
В конце 80–х – начале 90–х годов XX века в литературе появились публикации о применении нового метода удаления надпочечников – лапароскопической адреналэктомии. Преимуществами лапароскопической адреналэктомии являются: небольшое количество интраоперационных осложнений, незначительный болевой синдром, малая травматичность, сокращение пребывания пациента в стационаре, быстрое восстановление работоспособности. Однако до настоящего времени нет единого мнения о показаниях к лапароскопической адреналэктомии. При этом большинство хирургов считают, что при злокачественных опухолях и при размерах опухоли более 8,0 см лапароскопические вмешательства применять не следует.
Успех хирургического лечения опухолей надпочечников во многом зависит от предоперационной подготовки, адекватности обезболивания, а также ведения послеоперационного периода. Предоперационная подготовка должна проводиться с учетом степени гормональной активности опухоли, проявлений заболевания, его осложнений и сопутствующей патологии.
Нередко предоперационная подготовка может продолжаться несколько недель и требует совместных усилий терапевта–эндокринолога, хирурга и анестезиолога–реаниматолога. В целом она заключается в коррекции метаболических нарушений, лечении сопутствующих заболеваний, санации очагов инфекции.
На любом этапе операции могут возникнуть опасные для жизни осложнения, но наиболее важными этапами являются непосредственные манипуляции с опухолью, поэтому требуется четкая организация проведения наблюдения за основными жизненными органами и системами. Обязательными условиями являются: кардиомониторинг на всех этапах операции, динамический контроль артериального давления и центрального венозного давления.
В раннем послеоперационном периоде больные нуждаются в интенсивном наблюдении и рациональной терапии стероидными гормонами, коррекции электролитного обмена, щелочных резервов крови. Наряду с профилактикой и лечением надпочечниковой недостаточности необходимо учитывать тяжелое соматическое состояние больных. Расстройства минерального обмена, проявляющиеся чаще всего гипокалиемией, следует компенсировать введением препаратов калия в сочетании с антагонистами альдостерона (спиронолактон). Необходимы постоянный контроль за уровнем гликемии, достаточное введение жидкости, щелочных растворов, средств, улучшающих метаболизм и сократительную способность миокарда.
Химио–лучевое лечение
В литературе за последние годы появились отдельные сообщения о химио–лучевом лечении злокачественных опухолей надпочечников. Как правило, его применяют при первично распространенных опухолях либо при появлении метастазов после удаления первичной опухоли. Из препаратов чаще используются следующие: при опухолях коры надпочечников схема ВЕП – блеомицин 30 мг в/в 1 раз в неделю, 9 недель; этопозид 100 мг/м2, 1–5 дни; цисплатин 20 мг/м2, 1–5 дни. Цисплатин и этопозид повторяют каждые 3 недели. При наличии неоперабельной злокачественной опухоли мозгового слоя надпочечника, рецидива опухоли и метастазов чаще всего применяется схема DOC: дакарбазин 250 мг/м2 в/в, 1–5 дни; винкристин 1,5 мг/м2, 5–й день; циклофосфамин 750 мг/м2 в/в, 1–й день. Циклы повторяют каждые 3 недели.
В литературе имеются немногочисленные сообщения о применении лучевого лечения. Однако они касаются лишь использования лучевой терапии при наличии метастазов с целью уменьшения болевого синдрома.


К тому же www.rmj.ru не разрешает копировать их материалы.