Основные анатомо-функциональные особенности шейного отдела позвоночника, имеющие значение для лучшего понимания изменений, происходящих при ревматоидном артрите, приведены в опубликованной в этом журнале статье В.А. Мицкевича "Нестабильность шейного отдела позвоночника".
В.А.Мицкевич
Институт ревматологии РАМН, Москва
Шейный отдел позвоночника при ревматоидном артрите (РА)
после 10 лет заболевания оказывается вовлеченным в патологический процесс у 80%
больных [1]. При РА поражается синовиальная ткань, которая находится в суставах между
затылочной костью и первыми двумя шейными позвонками. Чаще всего в процесс
вовлекается верхнешейный уровень, а именно первый и второй шейные позвонки.
Пролиферация синовиальной ткани, выпот в синовиальные сочленения и синовит ведут к
растяжению суставной капсулы и разрушению хряща. Имеющееся при РА нарушение
остеогенеза приводит к развитию остеопороза, что облегчает деструкцию
позвонков.
Это приводят к разрушению мыщелков затылочной кости, зубовидного отростка позвонка СII, латеральных масс позвонка СI, а также к растяжению или разрыву
крыловидных и поперечных связок. При разрыве поперечной связки с деструкцией
боковых масс позвонков СI и СII на фоне их эрозии развивается нестабильность позвоночника. При нестабильности аталантоаксиального сочленения происходит подвывих позвонков СI и СII. При
подвывихе происходит смещение позвонка СI кпереди и зубовидного отростка позвонка СII кверху и кзади. При подвывихе дужка позвонка СI и
зубовидный отросток позвонка СII оказывают давление на спинной мозг. На
задней поверхности позвонка СII происходит рост грануляций, что приводит к
образованию паннуса, который оказывает непосредственное давление на переднюю
поверхность спинного мозга. Нестабильность шейного отдела позвоночника при РА
развивается на двух уровнях: атлантоаксиальном и субаксиальном.
Атлантоаксиальная нестабильность определяется по смещению позвонка СI по
отношению к СII.
Она включает в себя четыре типа смещений:
1. Передний подвывих.
Диагностируется чаще, чем остальные типы смещений. Частота встречаемости достигает
71% случаев [2]. Передний подвывих развивается при поражении поперечной крыловидной и
вершинной связок. У взрослого человека
смещение позвонка СI на 3 мм считается патологическим. Смещение
на 10–12 мм свидетельствует о разрушении всего связочного комплекса (рис. 1).
2. Задний подвывих. Частота достигает 7% [2]. Смещение позвонка СI кзади обусловлено эрозивной деструкцией или переломом зубовидного отростка позвонка СII.
3. Боковой подвывих. Встречается в 21% случаев [2]. Диагностируется при боковом смещении позвонков более 2 мм. Подвывих сопровождается ротацией головы в сторону.
4. Вертикальный подвывих. Частота встречаемости достигает 32% [2]. Носит
название псевдобазилярной инвагинации или аталантоаксиальной протрузии. Развивается
при эрозии костно-хрящевых структур, входящих в атлантоокципитальное или атлантоаксиальное сочленение. Определяется по смещению зубовидного
отростка кверху в направлении затылочного отверстия.
При РА в сегментах от СII до СVII развивается субаксиальная нестабильность и подвывих позвонков. Субаксиальный уровень поражается у 7–29% больных РА [2]. Подвывих развивается при эрозии фасеток межпозвоночных суставов, размягчении и
разрывах межостистых связок, а также при спондилодисците, который представляет собой специфическое ревматоидное поражении диска. Чаще всего подвывих имеет
место на уровне СII–СIII и СIII–СIV.
Он может быть спровоцирован нагрузкой на позвоночник. Прогрессирование нестабильности шейного отдела позвоночника происходит по мере развития РА. В 80% случаев наблюдается увеличение степени смещения позвонков СI и СII, а
приблизительно у 1/4 пациентов диагностируется новый подвывих позвонков в
субаксиальном отделе [2]. В публикациях, посвященных РА шейного отдела, приводится
разная частота случаев нестабильности позвоночника (от 40 до 80% [2]), которая
объясняется воздействием ряда факторов.
Во-первых, больные с нестабильностью атлантоаксиального отдела
в стационарах ревматологического профиля встречаются реже, чем в ортопедических или
нейрохирургических отделениях.
Во-вторых, большинству пациентов рентгенограммы шеи производятся только при
наличии боли и неврологической симптоматики, выявление которой имеет свои сложности, так как нестабильность на ранних стадиях процесса может протекать бессимптомно. Как правило, нестабильность развивается на фоне тяжелого ревматоидного полиартрита, при котором неврологические нарушения маскируются слабостью мышц, тугоподвижностью в суставах конечностей и наклоном головы в сторону. У таких больных сложно проверять состояние двигательной, чувствительной и рефлекторной сферы.
Неврологические нарушения
Неврологические нарушения при РА подразделяются на классы, которые были
предложены С.Ranavat (см. таблицу) [3, 4].
Неврологическая симптоматика развивается в результате давления нестабильных позвонков на нервные структуры. Неврологические осложнения нестабильности начинаются с радикулопатии,
когда в результате давления на корешки спинного мозга больного РА начинают беспокоить боли. При типичном течении РА в ранней стадии болезни пациент жалуется на боли в области шеи, затылка, а также на головную боль. Боль может иррадиировать в область лба и глазниц. Боль усиливается при сгибании, разгибании и ротации головы. Объективные неврологические признаки и
болевой синдром обнаруживаются с разной частотой. Прогрессирование неврологической симптоматики наблюдается
от 2 до 36% случаев, а частота боли колеблется в пределах от 7 до 34% [4]. При увеличении
смещения позвонков на фоне раздражения нервных корешков наступает компрессия спинного мозга. Причинами компрессии спинного мозга являются:
1) сужение просвета позвоночного канала вследствие смещения дужки позвонка,
грыжи межпозвонкового диска либо выбухания гипертрофированной желтой связки. При этом
может быть как непосредственное давление
на вещество спинного мозга, так и сдавление
передней и задней спинальной артерий
гипертрофированными связками;
2) сужение просвета позвоночного канала при разгибательных движениях головой кзади.
Сужение позвоночного канала больше 10 мм является критическим для спинного мозга. Компрессия спинного мозга приводит к миелопатии. Эта патология является относительно редкой, однако очень тяжелой. Приблизительно 50% больных с верифицированной миелопатией, которым проводится консервативное лечение, умирают в течение полугода [5].
Миелопатия развивается постепенно и чаще всего начинается с корешковой симптоматики.
Проявлением миелопатии является прогрессирование корешковой боли, слабость мышц конечностей, атрофия мышц, спастика, нарушение мочеиспускания. В течении
миелопатии имеются следующие варианты:
1. Эпизодическая неврологическая симптоматика – 75%.
2. Медленное прогрессирование процесса – 20%.
3. Быстрое развитие процесса – 5% [6].
В настоящее время не существует критериев прогноза миелопатии, однако действие следующих факторов увеличивает риск ее появления при РА:
1) мужской пол;
2) смещение позвонка СI кпереди больше чем на 9 мм;
3) вертикальный подвывиха позвонка СII[7].
Неврологическая картина не имеет прямой связи с данными рентгенологии, т.е. со степенью нестабильности позвонков. Увеличение смещения позвонков может не сопровождаться ухудшением неврологической симптоматики, и наоборот. В то время как рентгенологические признаки подвывиха
прогрессируют у 2/3 больных, ухудшение неврологической картины наблюдается не более чем у 1/3 пациентов [4]. По сравнению с рентгенологической картиной прогрессирование миелопатии и появление новых очагов нестабильности позвоночника в большей степени связано с течением
основного заболевания – РА. По подсчетам S.Lipson [2], частота нестабильности шейных позвонков коррелирует с частотой деструкцией пястно-фаланговых суставов, что наблюдается чаще у мужчин и дает основание для рентгенологического обследования шейного отдела позвоночника,
в первую очередь лицам мужского пола.
Методы исследования
1. Клиническое обследование позволяет выявить неврологические нарушения.
2. Стандартная рентгенография в боковой проекции дает достаточно данных для решения вопроса о смещении позвонковСведения о рентгенометрических методах диагностики нестабильности в верхнешейном отделе позвоночника приведены в опубликованной в этом журнале статье В.А. Мицкевича "Нестабильность шейного отдела позвоночника".. Метод расчета рентгенограмм по Редлунд-Ионелл является наиболее точным [8]. Величина заднего атлантоаксиального промежутка (ЗААП) коррелирует со степенью паралича, в то время как величина переднего атлантоаксиального промежутка не связана со степенью неврологических проявлений [7].
3. Электромиография (ЭМГ) является самым точным методом, который позволяет установить степень вовлеченности в процесс нервных структур. Проведение ЭМГ у больных РА затруднено в связи с контрактурами суставов и атрофией мышц.
4. Магнитно-резонансная томография позволяет выявить компрессию спинного мозга при отсутствии клинической симптоматики [9]. Данные томографии могут не соответствовать результатам клинического исследования, которые для принятия окончательного решения о лечении пациента оказываются наиболее важными [1]. Томограмма может оказаться необходимой при решении вопроса о технике хирургического вмешательства для субламинарного проведения проволоки с целью фиксации позвоночника.
Консервативное лечение
Больной РА с нестабильностью позвоночника, которая не осложнена неврологической симптоматикой, лечится консервативно. При нестабильности позвоночника ухудшение неврологической симптоматики наблюдается только у 1/3 больных с рентгенологическими признаками прогрессирования смещения позвонков [4]. У остальных больных стабилизация позвоночника происходит самостоятельно, что не вызывает необходимости хирургического вмешательства. Консервативное лечение заключается в ношении головодержателя, лечебной физкультуры, массаже мышц спины.
Больной РА с нестабильностью, которая осложнена неврологической симптоматикой, лечится как консервативными, так и оперативными методами. Целью консервативного метода является уменьшение степени выраженности неврологических проявлений. Консервативное лечение заключается в первую очередь в иммобилизации шейного отдела позвоночника с целью щажения спинного мозга и его корешков от раздражения. Иммобилизация достигается ношением жесткого или мягкого головодержателя. Мягкий головодержатель применяется относительно чаще [5]. Жесткий головодержатель назначается для постоянного ношения у больных при обнаружении начальных признаков миелопатии. Контрольный осмотр больного с миелопатией производится каждые 2–3 мес [4]. У больных РА с комбинированным поражением периферических суставов и шейного отдела позвоночника акцент противовоспалительной терапии смещается с суставов и проводится с учетом состояния верхнешейного отдела позвоночника. Критерием эффективности лечения является улучшение неврологической картины, вызванной нестабильностью позвоночника. Для лечения неврологических осложнений применяются курсы противовоспалительных и сосудистых препаратов. При отсутствии прогрессирования неврологической симптоматики рентгенография шейного отдела позвоночника производится 1 раз в год. Ухудшение неврологической симптоматики является основанием для назначения рентгенологического исследования.
Оперативное лечение
Оперативное лечение больного с миелопатией может быть проведено как в один,
так и в несколько этапов. Стадийность лечение зависит от выраженности
неврологической симптоматики и степени смещения позвонков. Успешное лечение
подвывиха позвонков включает их репозицию. Для вправления подвывиха позвонков
осуществляется тракция за череп с помощью halo-аппарата (рис. 2).
Вправление позвонков оказывается возможным при небольшой степени их смещения. Репозиция подвывиха позвонка СI достигается в том случае, если величина смещения не превышает 8 мм [9]. Варианты компоновки тракционного устройства зависят от состояния пациента. У ходячего больного halo-аппарат может быть фиксирован к гипсовому корсету, который накладывается на верхнюю часть туловища. У колясочного больного аппарат может быть фиксирован к
спинке коляски. Лечебная роль тракции заключается в том, что покой в верхнешейном отделе приводит к уменьшению синовита в межпозвонковых сочленениях и воспаления в области паннуса. У больных с низкой степенью активности РА halo-тракция может быть осуществлена как самостоятельный
метод лечения, без последующего вмешательства на позвонках. Применение
тракции в течение 4 мес позволяет вправить субаксиальный подвывих, получить
стабилизацию позвоночника и добиться уменьшения болей [5].
У больных с РА шейного отдела позвоночника хирургическая операция производится в 10–13% случаев. В отношении показаний к оперативному лечению
существуют разные мнения. Традиционно, на протяжении долгого времени считалось, что сама по себе нестабильность позвоночника не является показанием к операции, если при этом нет боли или неврологических проявлений, а оперативное лечение производилось при сдавлении спинного мозга. P.Pellicci и соавт. [4] выделил следующие показания к оперативному лечению при миелопатии:
1. Постоянная боль и отрицательная динамика неврологической симптоматики,
вызванная нестабильностью позвоночника.
2. Прогрессирование неврологической симптоматики до II класса при вертикальном и субаксиальном подвывихах.
3. Прогрессирование неврологической симптоматики до III класса при любом типе нестабильности позвоночника.
При миелопатии у больных РА шейного отдела позвоночника производятся следующие основные типы операций:
1. Ламинэктомия.
2. При базилярной импрессии – резекция зубовидного отростка СII
передним доступом [7].
3. При базилярной инвагинации, которую не удалось вправить с помощью
тракции – ламинэктомия СI и окципитоспондилодез СII.
4. При изолированном атлантоаксиальном подвывихе – задний
спондилодез на уровне СI–СII.
5. При субаксиальном подвывихе, который удалось вправить путем тракции –
задний спондилодез, а при отсутствии вправления – передний спондилодез [7].
6. При субаксиальном подвывихе – многоуровневая односторонняя
ламинопластика с задним спондилодезом [5].
Операция ламинэктомии чаще всего делается для декомпрессии спинного мозга
при переднем подвывихе позвонка СI. При РА сдавление спинного мозга на значительном протяжении может потребовать его декомпрессии путем расширенной ламинэктомии на нескольких уровнях от СIII до СVI или от СIV до СVII с отведением костных фрагментов в сторону по типу "открытой двери". В образовавшийся промежуток между костными структурами на твердую мозговую оболочку прокладывается жировая ткань для предупреждения образования рубцов [6].
Операция ламинэктомии при РА имеет ряд негативных сторон:
1) травматизация спинного мозга;
2) образование кифоза шейного отдела позвоночника;
3) прогрессирование смещения позвонков;
4) рубцовый процесс;
5) неэффективность декомпрессии при сдавлении спинного мозга по
передней поверхности.
В литературе отмечено, что в целом при лечении миелопатии, вызванной нестабильностью позвоночника, ламинэктомия не дает хороших результатов [10]. При тяжелой неврологической картине ламинэктомия не может считаться эффективным хирургическим вмешательством, так как не приводит к улучшению состояния больного. Это связано с тем, что ламинэктомия, как правило, делается поздно при далеко зашедшем процессе у тяжелых больных и представляет собой операцию отчаяния.
У больных миелопатией и РА после любого вида вмешательств боль и парестезия
проходят почти в 75% случаев. Частичное улучшение неврологической картины имеет место в 40% случаев, а полное ее восстановление наблюдается не более чем в 20% случаев. Выживаемость после операции зависит от исходного состояния больного. Через 2 года выживаемость у больных, оперированных по поводу болевого синдрома, равняется 62%, а у оперированных по поводу миелопатии составляет 67% [11]. Высокий процент смертности обусловлен тяжестью неврологических нарушений, вызванных ревматоидным процессом. Самая высокая смертность наблюдается у больных с тетрапарезом. По данным J.Oosveen [5], проанализировавшего большое число источников литературы, смертность после операции достигает 1/4 всех больных. Исход оперативного вмешательства можно предвидеть до вмешательства на основании следующих данных о состоянии больного:
1. При переднем подвывихе позвонка СI размер ЗААП
меньше 10 мм является плохим прогностическим признаком. При таком состоянии улучшения неврологического статуса после вмешательства не происходит.
Более благоприятным признаком является величина ЗААП 10 мм и более.
2. При вертикальном подвывихе улучшение неврологической картины после
операции можно ожидать только при величине ЗААП 13 мм и более [7].
Динамика неврологической симптоматики после операции связана со стабильностью позвоночника. Нестабильность позвоночника или невправленный подвывих у больных миелопатией является причиной отсутствия регресса неврологической симптоматики после любой операции. Для устранения нестабильности позвоночника показан спондилодез. При РА показанием к спондилодезу, по мнению S.Wertheim и соавт. [12], является прогрессирующая неврологическая симптоматика. При невправимом подвывихе регресса неврологической симптоматики после операции не происходит. Для устранения подвывиха в дооперационном периоде производится репозиция шейных позвонков путем тракции шейного отдела позвоночника. После тракции вторым этапом лечения осуществляется спондилодез. При невправимом подвывихе спондилодез осуществляется передним доступом, преимуществом которого является хороший обзор операционного поля. При псевдобазилярной инвагинации передний доступ дает возможность удалить паннус позади зубовидного отростка СII, который сдавливает спинной мозг [12].
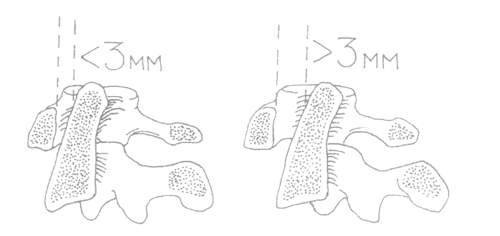
Рис. 1. Передний подвывих позвонка СI.
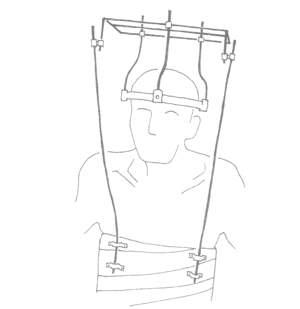
Рис. 2. Больной в halo-аппарате.
Классификация неврологических нарушений
| Класс | Неврологический статус |
| I | Отсутствие неврологических нарушений |
| II | Субъективная слабость мышц, нарушение чувствительности, гиперрефлексия |
| IIIA | Поражение проводящих путей спинного мозга. |
| Пациент нуждается в посторонней помощи | |
| IIIB | Поражение проводящих путей спинного мозга. Больной колясочный или лежачий |
Развитие методик оперативного лечения и послеоперационного ведения больных с РА способствует пересмотру показаний к операции на позвоночнике. Это касается возраста оперируемых и тяжести неврологического поражения. Пожилые больные переносят обширную операцию относительно плохо. Средний возраст больных, которым производится оперативное лечение по поводу нестабильности шейного отдела позвоночника, составляет 58–60 лет [1, 12], при средней продолжительности заболевания до 40 лет [3]. При параличе динамика неврологической картины после операции связана не с длительностью существования паралича, а со степенью его тяжести. Регресс неврологической симптоматики после операции обратно пропорционален степени выраженности поражения нервной системы до вмешательства. Процесс восстановления в послеоперационном периоде оказывается тем дольше, чем хуже было состояние больного до операции.
Негативное влияние пожилого возраста и степени тяжести процесса на исход операции является основанием для изменения тактики лечения. Современная тенденция заключается в том, чтобы делать операции в более молодом возрасте, когда больные относительно легче переносят вмешательство, которое производится с целью предотвращения развития тяжелых неврологических осложнений [3]. Существует мнение, что операция должна делаться с превентивной целью даже при отсутствии неврологической симптоматики. Это должна быть стабилизация шейного отдела позвоночника, которая уменьшает риск прогрессирования нестабильности и развития возможного паралича [7]. Согласно этой тактике показания к спондилодезу выглядят следующим образом:
1. Атлантоаксиальный подвывих. Размер ЗААП менее 14 мм.
2. Атлантоаксиальный подвывих в комбинации с псевдобазилярной инвагинацией без признаков компрессии спинного мозга. Смещение зубовидного отростка СII более 5 мм.
3. Субаксиальный подвывих. Размер позвоночного канала менее 14 мм.
Тактика ранних оперативных вмешательств встречает ряд возражений. Основным из них является отсутствие возможности предсказания течения миелопатии. В случае эпизодических симптомов и отсутствия болевого синдрома оперативный метод лечения может быть исключен из арсенала лечебных мероприятий. Превентивный подход оказывается неоправданным в связи с тем, что прогнозировать динамику неврологической симптоматики после операции оказывается трудно. После спондилодеза признаки компрессии спинного мозга продолжают прогрессировать у 10% больных, не смотря на стабилизацию позвоночника [4]. Послеоперационный период может осложниться развитием ряда патологических состояний, которые сами по себе могут потребовать повторного вмешательства. К ним относятся:
1) субаксиальный гиперлордоз, вызванный halo-тракцией;
2) субаксиальный подвывих позвонков ниже уровня спондилодеза;
3) рецидив подвывиха СI–СII при недостаточной фиксации позвонков;
4) спондилодисцит;
5) паннус;
6) рассасывание костного трансплантата;
7) инфекция.
Рецидив подвывиха, паннус и спондилодисцит могут быть причиной повторной компрессии спинного мозга в послеоперационном периоде и являются показанием к оперативному лечению. Рассасывание костного трансплантата наблюдается в 10% случаев после спондилодеза, что ставит вопрос о повторной фиксации позвоночника [3]. В 25% случаев спондилодез осложняется инфекцией [1]. Инфекционные осложнения лечатся консервативно, однако при генерализации гнойного процесса может потребоваться проведение повторной операции для его ликвидации. Частота нагноений связана с дозой кортикостероидов, которые принимает больной. Показания к назначению стероидных препаратов имеются у половины ревматологических больных во время их подготовки к хирургическому лечению в стационаре [3]. Отмена стероидов ведет к тому, что после операции происходит прогрессирование РА с появлением новых очагов нестабильности в шейном отделе позвоночника.
Заключение
Нестабильность позвоночника при РА осложняется компрессией спинного мозга и миелопатией, для которой характерна высокая смертность. Нестабильность позвоночника при РА без неврологической симптоматики лечится консервативными методами. Для лечения неврологических осложнений чаще применяются консервативные методы лечения и, реже, оперативные методы. Однозначной тактики лечения таких больных до настоящего времени не выработано. Пациенты с миелопатией являются тяжелыми соматическими больными, вынужденными принимать большие дозы гормональных препаратов. При миелопатии применяется выжидательная тактика, в результате чего операция откладывается на неопределенный срок. Консервативное лечение не всегда способно остановить прогрессирование миелопатии. В результате отсутствия критериев состояния больного с миелопатией и неразработанности прогнозирования течения заболевания операция производится поздно и не дает желаемых результатов. Превентивные вмешательства с целью стабилизации шейного отдела позвоночника не снискали всеобщей поддержки в связи с их высоким риском и отсутствием гарантии полного предотвращения развития болезни. Методика хирургического вмешательства, операционный доступ, способ фиксации и т.д. являются объектом изучения и предметом дискуссии. В настоящее время лечение шейной миелопатии при РА представляет собой сложную проблему, для решения которой требуются усилия врачей нескольких специальностей: ревматологов, невропатологов, ортопедов, нейрохирургов, реабилитологов и т.д.
Литература
1. Hamilton J, Gordon M, McInnes J et al. Ann Rheum Dis 2000; 59: 434–8.
2. Lipson S. Clin Orthop 1989; 239: 121–229.
3. McRorie E, McLoughlin. Ann Rheum Dis 1996; 55: 99–103.
4. Pelicci P, Ranavat C, Tsairis P, Bryan W. J Bone Joint Surg 1981; 63-A (3): 342–6.
5. Oosveen J, Martin A, Gleen J. Ann Rheum Dis 1999; 58: 126–30.
6. Herkowitz H. Clin Orthop 1989; 239: 94–9.
7. Boden S, Dode L, Bohlman H, Rehtine G. J Bone Joint Surg 1997; 75-A (9): 1282–91.
8. Kawaida H, Sakou T, Morizono Y. Clin Orthop 1989; 239: 128–33.
9. Sakou T, Kawaida H, Morizono I et al. Clin Orthop 1989; 239: 136–42.
10. Conaty P, Mongan E. J Bone Joint Surg 1981; 63-A (8): 1281–9.
11. Asselt van K, Lems W, Bongartz E. Ann Rheum Dis 2001; 60: 448–52.
12. Wertheim S, Bohlman H. J Bone Joint Surg, 69-A (6): 833–9.